| Fenyllithium | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | fenyllithium |
| Sumární vzorec | C6H5Li |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 591-51-5 |
| EC-no (EINECS/ELINCS/NLP) | 209-720-1 |
| PubChem | 637932 |
| SMILES | [Li+].C1=CC=[C-]C=C1 |
| InChI | InChI=1S/C6H5.Li/c1-2-4-6-5-3-1;/h1-5H;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 84,047 g/mol |
| Teplota varu | 140 až 143 °C (413 až 416 K) |
| Hustota | 0,828 g/cm3 |
| Rozpustnost ve vodě | reaguje |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 48,3 až 52,5 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H226 H250 H261 H302 H312 H314 H332[1] |
| P-věty | P210 P222 P331+332 P233 P240 P241 P242 P243 P260 P261 P264 P270 P271 P280 P301+312 P301+330+331 P302+334 P302+352 P303+361+353 P304+312 P304+340 P305+351+338 P310 P312 P321 P322 P330 P363 P370+378 P402+404 P403+235 P405 P422 P501[1] |
Některá data mohou pocházet z datové položky. | |
Fenyllithium je organokovová sloučenina se vzorcem C6H5Li. Používá se v organické syntéze jako metalační činidlo a jako náhrada Grignardových činidel při zavádění fenylových skupin do sloučenin.[2] Krystalické fenyllithium je bezbarvé, roztoky však mohou mít různé odstíny hnědé nebo červené barvy, v závislosti na použitém rozpouštědlu a nečistotách.[3]
Příprava
Fenyllithium bylo poprvé připraveno reakcí kovového lithia s difenylrtutí:[4]
- (C6Η5)2Ηg + 2Li → 2C6Η5Li + Ηg
Další možností přípravy je reakce fenylhalogenidu s lithiem:
- X-Ph + 2Li → Ph-Li + LiX
Fenyllithium lze rovněž získat podvojnou záměnou:
- n-BuLi + X-Ph → n-BuX + Ph-Li
Nejčastěji se používají předcházející dva postupy.
Reakce
Hlavní využití fenyllithia spočívá v tvorbě vazeb uhlík-uhlík nukleofilní adicí a substitucí:
- PhLi + R2C=O → PhR2COLi
Reakcí fenyllithia s pyridinem vzniká 2-fenylpyridin v reakci zahrnující adičně-eliminační mechanismus:[5]
- C6H5Li + C5H5N → C6H5-C5H4N + LiH
Struktura a vlastnosti
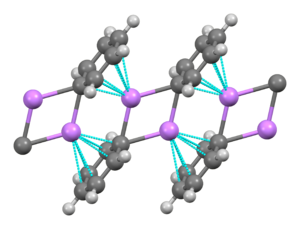
Fenyllithium vytváří monoklinické krystaly. Pevné fenyllithium se skládá z dimerních jednotek Li2Ph2. Atomy lithia a ipso uhlíky fenylových kruhů vytváří rovinný čtyřčlenný cyklus. Rovina, ve které jsou fenyly, je na tyto Li2C2 kruhy kolmá. Mezi fenyllithiovými dimery a π-elektrony fenylových skupin sousedních dimerů se objevují další mezimolekulární interakce, čímž se vytváří polymerní řetězce.[6]
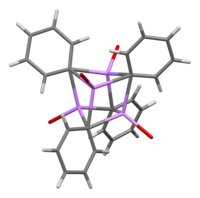
V roztoku může mít fenyllithium, v závislosti na vlastnostech rozpouštědla, řadu různých struktur. V tetrahydrofuranu se vyskytuje rovnováha mezi monomerem a dimerem. V diethyletheru, což je forma, ve které se prodává nejčastěji, vytváří tetramer. Čtyři atomy lithia a čtyři atomy uhlíku obsazují vrcholy deformované krychle.
Průměrná délka vazeb C–Li je 233 pm. Molekuly etheru se na Li vážou přes své kyslíkové atomy. Za přítomnosti LiBr se přímou reakcí lithia s fenylhalogenidem tvoří vedlejší produkt, komplex [(PhLi•Et2O)4] se mění na [(PhLi•Et2O)3•LiBr). Atomy lithia v LiBr zaujímají jedno z míst kubanové struktury a atomy Br se nachází na sousedních místech, která odpovídají uhlíkům.[7]
Reference
V tomto článku byl použit překlad textu z článku Phenyllithium na anglické Wikipedii.
- ↑ a b c d Phenyllithium. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a15_393.pub2. (anglicky) DOI: 10.1002/14356007.
- ↑ H. Gilman; E. A. Zoellner; W. M. Selby. An Improved Procedure for the Preparation of Organolithium Compounds. Journal of the American Chemical Society. 1932, s. 1957–1962. DOI 10.1021/ja01344a033.
- ↑ D. P. Green; D. Zuev. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: Wiley and Sons, 2008. ISBN 978-0471936237. DOI 10.1002/047084289X.rp076.pub2. Kapitola Phenyllithium.
- ↑ Evans, J. C. W.; Allen, C. F. H. "2-Phenylpyridine" Organic Syntheses (1938), vol. 18, p. 70 DOI:10.15227/orgsyn.018.0070Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ R. E. Dinnebier; U. Behrens; F. Olbrich. Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction. Journal of the American Chemical Society. 1998, s. 1430–1433. DOI 10.1021/ja972816e.
- ↑ H. Hope; P. P. Power. Isolation and Crystal Structures of the Halide-Free and Halide-Rich Phenyllithium Etherate Complexes [(PhLi•Et2O)4] and [(PhLi•Et2O)3•LiBr]. Journal of the American Chemical Society. 1983, s. 5320–5324. DOI 10.1021/ja00354a022.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fenyllithium na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fenyllithium na Wikimedia Commons
| Zdroj dat | cs.wikipedia.org |
|---|---|
| Originál | cs.wikipedia.org/wiki/Fenyllithium |