| Ethoxid sodný | |
|---|---|
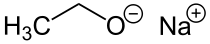 Strukturní vzorce ethoxidu sodného | |
| Obecné | |
| Systematický název | ethoxid sodný |
| Ostatní názvy | ethanolát sodný |
| Anglický název | Sodium ethoxide |
| Německý název | Natriumethanolat |
| Funkční vzorec | CH3CH2ONa |
| Sumární vzorec | C2H5ONa |
| Vzhled | bílá tuhá látka |
| Identifikace | |
| Registrační číslo CAS | 141-52-6 |
| EC-no (EINECS/ELINCS/NLP) | 205-487-5 |
| Indexové číslo | 603-041-00-8 |
| SMILES | [Na+].[O-]CC |
| InChI | InChI=1S/C2H5O.Na/c1-2-3;/h2H2,1H3;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 68,05 g/mol |
| Teplota tání | 260 °C |
| Hustota | 0,868 g/cm3 |
| Disociační konstanta pKa | 15,5 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H251 H314 EUH014 |
| R-věty | R11 R14 R34 |
| S-věty | S1/2 S8 S16 S26 S43 S45 |
| NFPA 704 |  2
2
1
|
Některá data mohou pocházet z datové položky. | |
Ethoxid sodný (též ethanolát sodný) je organická sloučenina patřící mezi alkoxidové soli. Má chemický vzorec C2H5ONa. Za běžných podmínek se jedná o bílou tuhou látku.
Příprava
Ethoxid sodný je komerčně dostupný jako tuhá látka nebo rozpuštěný v ethanolu. Lze ho snadno připravit reakcí kovového sodíku s ethanolem:
- 2 C2H5OH + 2 Na → 2 C2H5ONa + H2
Alternativní, levnější cestou je reakce hydroxidu sodného s bezvodým ethanolem. Takto se převede většina hydroxidu na ethoxid, vyšší čistoty lze dosáhnout odstraněním vody, například refluxem skrz kolonu s desikantem, čímž se posouvá rovnováha směrem vpravo.
- C2H5OH + NaOH ⇌ C2H5ONa + H2O
Ethanolový roztok se při skladování postupně zbarvuje červeně, protože podléhá vzdušné oxidaci.[2]
Použití
Ethoxid sodný se běžně používá v Claisenově kondenzaci a syntéze malonesterů, je-li jedním z reaktantů ethylester. Ethoxid může buď deprotonovat α-pozici na esteru nebo může ester podléhat nukleofilní substituci. Pokud je výchozí surovinou ethylester, nemůže dojít ke změně uspořádání, protože produkt je identický s výchozím materiálem.
Bezpečnost
Ethoxid sodný je silně zásaditý. Prudce reaguje s vodou za vzniku hořlavého ethanolu a žíravého hydroxidu sodného. Snadno se také oxiduje, což může být nebezpečné při smísení s elektrofilními látkami.
- C2H5ONa + H2O → C2H5OH + NaOH
Reference
V tomto článku byl použit překlad textu z článku Sodium ethoxide na anglické Wikipedii.
- ↑ a b Sodium ethoxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ M. Eagleson "Concise encyclopedia chemistry" p.997.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Ethoxid sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ethoxid sodný na Wikimedia Commons
| Zdroj dat | cs.wikipedia.org |
|---|---|
| Originál | cs.wikipedia.org/wiki/Ethoxid_sodný |