| Chlorid seleničitý | |
|---|---|
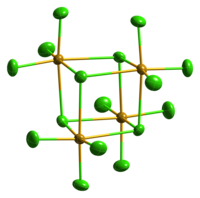 Tetramerní jednotka chloridu seleničitého | |
 Krystalová struktura chloridu seleničitého | |
| Obecné | |
| Systematický název | Chlorid seleničitý |
| Anglický název | Selenium tetrachloride |
| Německý název | Selentetrachlorid |
| Sumární vzorec | SeCl4 |
| Vzhled | bílé až žluté krystaly |
| Identifikace | |
| Registrační číslo CAS | 10026-03-6 |
| PubChem | 66205 |
| SMILES | Cl[Se](Cl)(Cl)Cl |
| InChI | InChI=1S/Cl4Se/c1-5(2,3)4 |
| Vlastnosti | |
| Molární hmotnost | 220,771 g/mol |
| Teplota tání | 191,4 °C (sublimuje) |
| Hustota | 2,6 g.cm−3 |
| Rozpustnost ve vodě | rozkládá se |
Některá data mohou pocházet z datové položky. | |
Chlorid seleničitý, SeCl4, je anorganická sloučenina selenu a chloru. Tvoří žluté až bílé těkavé krystaly. Je jedním ze dvou běžných chloridů selenu, druhým je Se2Cl2. Využívá se při syntéze sloučenin selenu.
Příprava
Připravuje se přímou reakcí selenu s chlorem.[1] Při zahřívání dochází k sublimaci produktu. Těkavosti chloridu je možné využít k čištění selenu.
Struktura
Pevný SeCl4 vytváří tetramerní kubickou strukturu.[1] Atomy selenu tvořící oktaedry SeCl6 obsazují čtyři vrcholy krychle, zbylé čtyři jsou tvořeny můstkovými chloridy. Můstkové vazby Se-Cl jsou delší než terminální vazby Se-Cl, úhly Cl-Se-Cl jsou přibližně 90°.[2]
Reakce
V přítomnosti vody hydrolyzuje za vzniku kyseliny seleničité:[3]
- SeCl4 + 3 H2O → H2SeO3 + 4 HCl
S chloridy alkalických kovů v prostředí koncentrované HCl poskytuje komplexní sloučeniny:[4]
- SeCl4 + 2 KCl → K2[SeCl6]
S chloridem hlinitým reaguje za vzniku kationtu SeCl +
3 :[4]
- SeCl4 + AlCl3 → SeCl +
3 + AlCl −
4
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Selenium tetrachloride na anglické Wikipedii.
- ↑ a b GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 947–948.
- ↑ KNIEP, Rüdiger; KÖRTE, Lutz; MOOTZ, Dietrich. Kristallstruktur der stabilen Modifikation von SeCl 4 / Crystal Structure of the Stable Modification of SeCl 4. Zeitschrift für Naturforschung B. 1981-12-01, roč. 36, čís. 12, s. 1660–1662. Dostupné online [cit. 2023-02-12]. ISSN 1865-7117. DOI 10.1515/znb-1981-1231. (anglicky)
- ↑ Chemical Papers. www.chemicalpapers.com [online]. [cit. 2023-02-12]. Dostupné online.
- ↑ a b HOUSECROFT, Catherine E. Anorganická chemie. Vyd. 1. vyd. Praha: Vysoká škola chemicko-technologická v Praze xxx, 1119 s. s. ISBN 978-80-7080-872-6, ISBN 80-7080-872-1. S. 558.
Externí odkazy
 Obrázky, zvuky či videa k tématu Chlorid seleničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorid seleničitý na Wikimedia Commons
| Zdroj dat | cs.wikipedia.org |
|---|---|
| Originál | cs.wikipedia.org/wiki/Chlorid_seleničitý |

