| Chroman draselný | |
|---|---|
 Vzhled | |
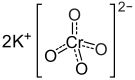 Struktura | |
| Obecné | |
| Systematický název | Chroman draselný |
| Sumární vzorec | K2CrO4 |
| Vzhled | žlutá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7789-00-6 |
| Vlastnosti | |
| Molární hmotnost | 194,19 g/mol |
| Teplota tání | 968 °C, 1 241 K |
| Teplota varu | 1 000 °C, 1 273 K |
| Hustota | 2,732 0 g/cm3 |
| Index lomu | 1,74 |
| Rozpustnost ve vodě | 62,9 g/100 g H2O (při 20 °C) 79,2 g/100 g H2O (při 100 °C) |
| Rozpustnost v polárních rozpouštědlech | nerozpustný v ethanolu |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H340 H350i H319 H335 H317 H315 H410 |
| P-věty | P201 P273 P280 P305 P308 P302 |
Některá data mohou pocházet z datové položky. | |
Chroman draselný je žlutá krystalická látka se vzorcem K2CrO4.
Výroba
Tato látka se běžně vyrábí reakcí oxidu chromitého s hydroxidem draselným za přítomnosti oxidačního činidla, v tomto případě dusičnanu draselného:
2Cr2O3 + 8KOH + 6KNO3 —t→ 4K2CrO4 + 4H2O + 6KNO2
V minulosti se tato látka vyráběla průmyslově zahříváním chromitu (FeCr2O4) s potašem (K2CO3) na vysokou teplotu, vzniklé množství chromanu draselného bylo rozpuštěno ve vodě a odfiltrováno od nerozpustných nečistot. Vzniklý produkt byl silně znečištěn, pro původní účely to ale bylo dostačující.
Reakce
V kyselém prostředí (nejčastěji s kyselinou dusičnou, s mnoha dalšími reaguje jinak!) se dvě molekuly chromanu draselného spojují za vzniku dichromanové molekuly, dle rovnice:
2K2CrO4 —HNO3→ 2K+ + K2Cr2O7
Průběh reakce je doprovázen změnou barvy roztoku ze žluté do oranžova.
V extrémně kyselém prostředí (opět s kyselinou dusičnou) se spojují tři molekuly za vzniku trichromanu, dle rovnice:
3K2CrO4 —HNO3→ 4K+ + K2Cr3O10
Roztok mění barvu z jasně žluté barvy přes oranžovou až po krvavě červenou barvu, způsobenou trichromanem draselným.
S kyselinou sírovou reaguje za vzniku kyseliny chromové, ta se pak dále rozpadá na oxid chromový.
K2CrO4 + H2SO4 → H2CrO4 + K2SO4 → H2O + CrO3 + K2SO4
S kyselinou chlorovodíkovou reaguje za vzniku chloridu draselného, chromitého a chloru:
2K2CrO4 + 12HCl → 4KCl + 2CrCl3 + 6H2O + Cl2
Dále tato látka reaguje s dusičnanem olovnatým za vzniku chromanu olovnatého, též zvaný chromová žluť:
K2CrO4 + Pb(NO3)2 → PbCrO4 + 2KNO3
Využití
Dříve se tato látka ve velké míře používala již zmíněnou reakcí na výrobu chromové žluti. Její používání se však v Evropě pro toxicitu a karcinogenitu již omezuje, stále je však ve velké míře užíváno ve Spojených státech.
Tato látka se dále využívá v chemickém průmyslu, zejména pak na syntézu dichromanu s celou řadou užití.
Bezpečnost
Tato látka je velice jedovatá při požití. Tato látka je taky karcinogenní, při vdechování je spojován s rakovinou plic. Při smíchání s hořlavými látkami dochází často ke vznícení, jedná se totiž o silné oxidační činidlo.
Reference
V tomto článku byl použit překlad textu z článku Potassium chromate na anglické Wikipedii.
- ↑ a b Potassium chromate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu chroman draselný na Wikimedia Commons
Obrázky, zvuky či videa k tématu chroman draselný na Wikimedia Commons
| Zdroj dat | cs.wikipedia.org |
|---|---|
| Originál | cs.wikipedia.org/wiki/Chroman_draselný |




